Semakin dekat nilai afinitas elektron maka semakin kuat ikatannya. HF asam florida.

Pengertian Senyawa Kovalen Polar Dan Nonpolar Serta Perbedaannya
Ikatan yang terjadi antara ion-ion logam dan non logam Ikatan terbentuk akibat gaya tarik listrik antara ion yang berbeda Ikatan ion juga dikenal sebagai ikatan elektrovalen.

. Contoh pada senyawa CH 4. Akan tetapi cara menggambarkan struktur lewis satu per satu terasa kurang efisien jika dalam soal terdapat lebih dari 5 jenis senyawa. Ikatan antar atomnya bersifat polar namun molekulnya bersifat nonpolar dikarenakan bentuknya yang simetris dengan sudut sama besar.
Senyawa kovalen bersifat polar apabila dilarutkan kedalam air karena air merupakan pelarut polar. Senyawa kovalen berwujud lunak dan tidak mudah rapuh. Memiliki kutub dan kutub - akibat tidak.
Pengertian dan Tata Nama Senyawa. -memiliki pasangan elektron bebas bila bentuk molekul diketahui atau memiliki perbedaan keelektronegatifan. Senyawa ion juga lebih larut dalam air dibandingkan senyawa kovalen.
Ikatan kovalen koordinasi adalah ikatan yang terjadi jika pasangan elektron yang dipakai bersama hanya berasal dari satu atom saja sedangkan yang lain tidak menyumbangkan elektron. Ikatan Kovalen Non Polar. Senyawa kovalen tidak memiliki kemampuan ini karena mereka tidak mengandung ion.
Senyawa kovalen polar dalam bentuk larutannya dapat terionisasi sempurna atau terionisasi sebagian menjadi ion-ionnya sehingga dapat menghantarkan arus listrik. Contoh senyawa kovalen polar yaitu HCl HBr HI HF H 2 O dan NH 3. Senyawa kovalen tidak larut dalam pelarut polar namun larut dalam pelarut organik.
Hal ini disebabkan oleh cara pembentukan ikatan yang berbeda. Memiliki pasangan elektron bebas bentuk tdk simetris Berakhir ganjil kecuali BX3 dan PX5. Lelehan wujud ini dapat menghantarkan listrik karena dalam bentuk lelehan ion-ionnya bergerak relatif bebas.
Senyawa kovalen memiliki ikatan kovalen. Senyawa kovalen tidak memiliki bidang simetris seperti H 2 O dan NH 3. Senyawa ionik terbentuk oleh transfer elektron yang bermuatan.
Perbedaan kovalen polar dan nonpolar. Dengan demikian setiap atom dapat mencapai konfigurasi elektronik gas mulia. Untuk memahami perbedaan wujud senyawa ionik dan kovalen polar ini berikut penjelasannya.
Ikatan kovalen nonpolar adalah ikatan kovalen yang terbentuk ketika atom membagikan elektronnya secara setara sama. Senyawa dapat berupa senyawa ionik dan senyawa kovalen tergantung pada jenis ikatan antara atom-atom penyusunnya. Dapat larut dalam air.
Sebuah atom berfungsi sebagai pemberi pasangan. Berikut ini akan dibahas mengenai perbedaan sifat fisika senyawa ion dan senyawa kovalen yang meliputi titik leleh dan titik didih kemudahan menguap volatile daya hantar listrik dan kelarutan. Ikatan kovalen adalah jenis ikatan kimia utama yang menghubungkan atom dalam suatu senyawa kimia.
Dari gambar struktur lewis di atas maka senyawa yang berikatan kovalen polar adalah senyawa NH 3 HF dan H 2 O sedangkan senyawa yang berikatan kovalen nonpolar adalah CH 4. Tidak terdapat perbedaan keelektronegatifan. Alkohol HCl PCl3 H2O N2O5.
Berdasarkan kepolarannya senyawa kovalen terbagi menjadi senyawa kovalen polar dan senyawa kovalen non polar. Dapat terbentuk apabila unsur-unsur yang bereaksi mempunyai perbedaan daya tarik elektron yang cukup besar Perbedaan yang besar memungkinkan terjadi serah-terima. Perbedaan Senyawa Polar dengan Non Polar.
Ciri-ciri senyawa polar. Antara molekul air dan molekul zat terlarut akan terjadi tarik menarik yang cukup kuat untuk memutuskan ikatan-ikatan molekul tertentu dan membentuk ion. Padatan wujud ini tidak dapat menghantarkan listrik karena dalam bentuk padatan tidak ada ion yang bergerak secara bebas.
Jika dua atom nonlogam sejenis diatomik membentuk suatu senyawa kovalen misalkan H2 N2 Br2 dan I2 maka ikatan kovalen yang terbentuk memiliki keelektronegatifan yang sama atau tidak. Polaritas muncul karena perbedaan elektronegativitas. Momen dipol akan timbul apabila senyawa kovalen tersebut tersusun dari dua atom dengan keelektronegatifan yang berbeda.
Senyawa kovalen polar biasanya terjadi antara atom-atom unsur yang beda keelektronegatifannya besar mempunyai bentuk molekul asimetris dan mempunyai momen dipol tidak sama dengan nol 0. Perbedaan Ikatan Kovalen Polar Ikatan Kovalen Nonpolar 1 Keelektronegatifan Terdapat perbedaan keelektronegatifan. Ikatan kovalen polar adalah ikatan kovalen yang pasangan elektron yang dipakai bersama cenderung tertarik ke salah satu atom yang berikatan.
- Senyawa pada polar bisa dicampur dengan senyawa polar lainya dan senyawa Non-polar akan berpisah Ikatan senyawa kovalen Polar dan Non Polar. H2 N2 F2 2 Pasangan Elektron Bebas PEB Atom pusat memiliki pasangan elektron bebas PEB. Jadi ikatan kovalen ini syaratnya ada molekul yang atom pusatnya mempunyai pasangan elektron bebas PEB.
Senyawa kovalen memiliki titik didih dan titik leleh yang rendah. Senyawa kovalen bersifat polar apabila senyawa tersebut memiliki ciri-ciri sebagai berikut. Contoh senyawa kovalen nonpolar yaitu H 2 O 2 N 2 Cl 2 CH 4 C 6 H 6 dan BF 3.
Kepolaran suatu senyawa dapat ditentukan dari perbedaan keelektronegatifan atom-atom yang membentuk suatu senyawa kovalen. Ikatan kovalen polar akan terjadi jika atom atom yang berikatan adalah heterointi. Senyawa kovalen mereka memiliki ikatan kovalen dalam strukturnya ikatan kovalen terbentuk ketika atom non-logam bersatu dan bersama-sama berbagi elektron.
Gula C6H12H6 Gas metana CH4 Diskusi. Senyawa kovalen tidak dapat menghantarkan listrik. Apa itu Ikatan Kovalen Polar.
Ukuran Kuantitatif Titik Didih Senyawa Kovalen Senyawa polar titik didihnya lebih tinggi daripada senyawa non polar. Ada dua jenis ikatan kovalen yaitu ikatan kovalen non-polar dan ikatan kovalen polar. HF HCl dan HBr.
Dapat larut dalam air dan pelarut polar lain. Proses Mekanisme Terjadinya Kepolaran Senyawa Kovalen. Biasanya terjadi ketika ada atom mempunyai afinitas elektron yang sama atau hampir sama.
Hal ini karena air melarutkan zat polar yang merupakan konsistensi senyawa ionik sedangkan senyawa kovalen non-polar. Jumlah atom 2 harus berbeda. Sifat fisis senyawa ion umumnya berbeda dengan senyawa kovalen.
Adanya polarisasi karena adanya perbedaan keelektronegatifan antar 2 unsur atom yang berbeda yang menyebabkan ikatan kovalen dapat dibagi menjaadi ikatan kovalen polar dan ikatan kovalen nonpolar. Sebaliknya jika tidak memiliki perbedaan harga keelektronegatifam antar kedua atom yang berikatan maka akan semakin nonpolar ikatannya.
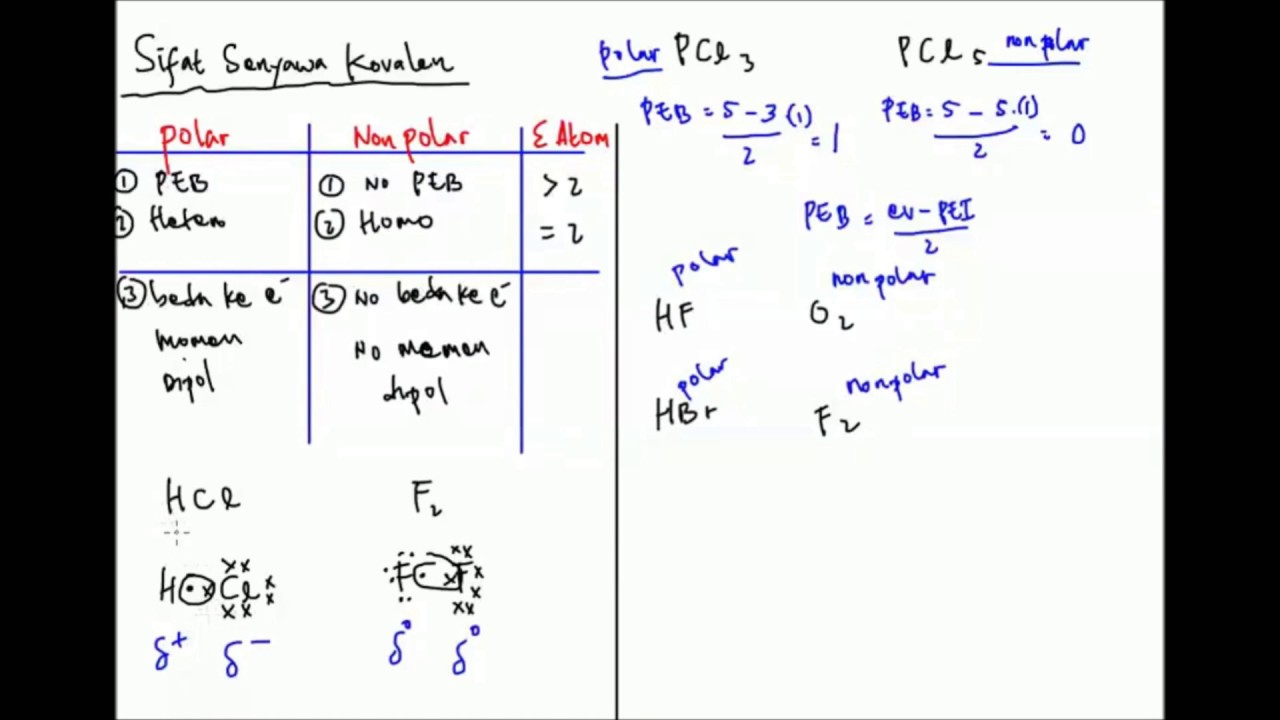
Pembahasan Kovalen Polar Dan Non Polar Konsep Jitu Youtube

Tabel Periodik Unsur Unsur Kimia Adolah Gambaran Unsur Unsur Kimia Dalam Bantuk Tabel Unsur Unsur Tasabu Periodic Table Chemistry Basics Life Hacks For School

Ikatan Kovalen Polar Dan Nonpolar Pdf
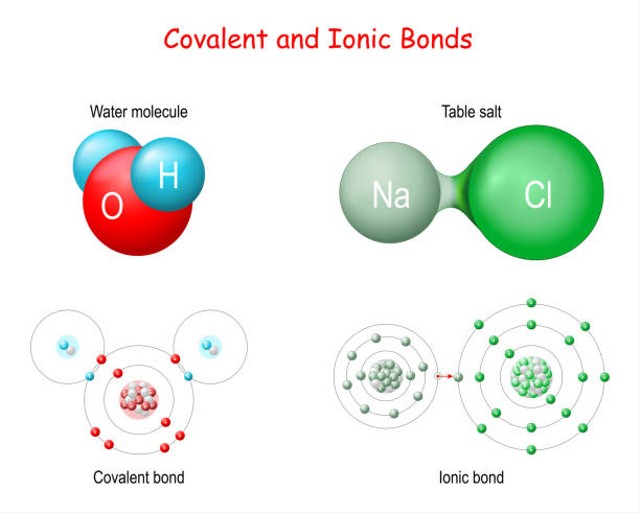
Perbedaan Senyawa Ionik Dan Senyawa Kovalen Polar Kumparan Com

Ikatan Ion Ikatan Kovalen Senyawa Polar Non Polar Gaya Antar Molek

Ikatan Kovalen Non Polar Kovalen Polar Dan Kovalen Semi Polar Youtube

Perbedaan Senyawa Ion Senyawa Kovalen Dan Logam Utakatikotak Com

Pengertian Ikatan Kovalen Polar Dan Non Polar Serta Hubungan Keelektronegatifannya Jempol Kimia

Perbedaan Polar Dan Nonpolar Apayangdimaksud Com

Kimia Kelas X Ikatan Kovalen Polar Non Polar Senyawa Kovalen Polar Dan Senyawa Kovalen Nonpolar Youtube
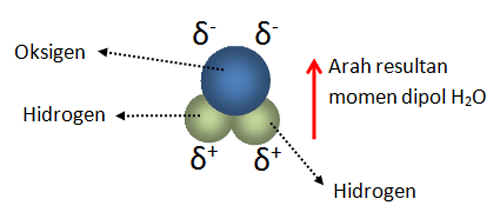
Ikatan Kovalen Nonpolar Polar Dan Koordinasi Siswapedia

Ikatan Kimia Ikatan Kovalen Polar Non Polar Kimia Sma Kelas 10 Youtube
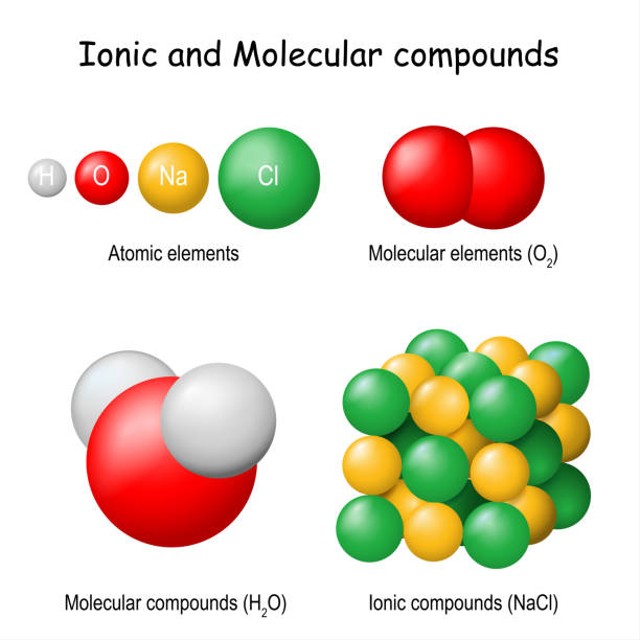
Perbedaan Senyawa Ionik Dan Senyawa Kovalen Polar Kumparan Com

Ikatan Kimia Pengertian Aturan Jenis Ikatan Kimia Contoh Informasainsedu

Ikatan Kovalen Polar Dan Non Polar Dalam Kehidupan Sehari Hari Kelassaefuddin Pmpk1 Youtube

Perhatikan Sifat Sifat Senyawa Berikut Yang T

Daya Hantar Listrik Senyawa Ion Kovalen Polar Kovalen Nonpolar Part 8 Otosection

Trik Super Kilat Membedakan Senyawa Ion Dan Senyawa Kovalen Youtube

